- 알츠하이머 데이터 발표가 향후 CNS 방향성 결정 - 키움증권 - 2020.07.24
consensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=566661
- NK 세포치료제, Next CAR-T - 하이투자 - 2020.07.22
consensus.hankyung.com/apps.analysis/analysis.downpdf?report_idx=566501
CAR-T의 붐 그 후 3년. 어디까지 왔을까?
Beyond CAR-T, NK 세포치료제
Appendix) 면역세포치료제
Ⅰ. CAR-T 의 붐 그 후 3 년. 어디까지 왔을까?
17~18 년도의 세포치료제 붐. 19 년도 다소 시들
17~18 년도 바이오 업계는 CAR-T 에 환호했다. 노바티스의 킴리아(Kymriah)와 길리어드의 예스카타
(Yescarta)가 드라마틱한 결과를 바탕으로 최초의 CAR-T 로 FDA 승인을 받았고, 길리어드-카이트파마의
119 억달러 규모의 M&A와 세엘진-주노테라퓨틱스의 90 억달러 규모의 M&A 등 초 빅딜이 연달아 있었다.
그러나 CAR-T 는 안전성 이슈와 동종유래에서 오는 생산의 어려움과 비용 문제로 19 년 기준 킴리아는
약 $278M, 예스카타는 $457M 의 매출을 기록하며 기대 이하의 성적을 보이고 있는 중이다.
CAR-T 관련 빅딜 역시 18 년 이후로 부재하며 CAR-T 의 붐은 끝나가는 듯 보였다.
그러나 차세대 CAR-T, 그리고 CARNK를 중심으로 변화의 흐름이 나타나고 있다.
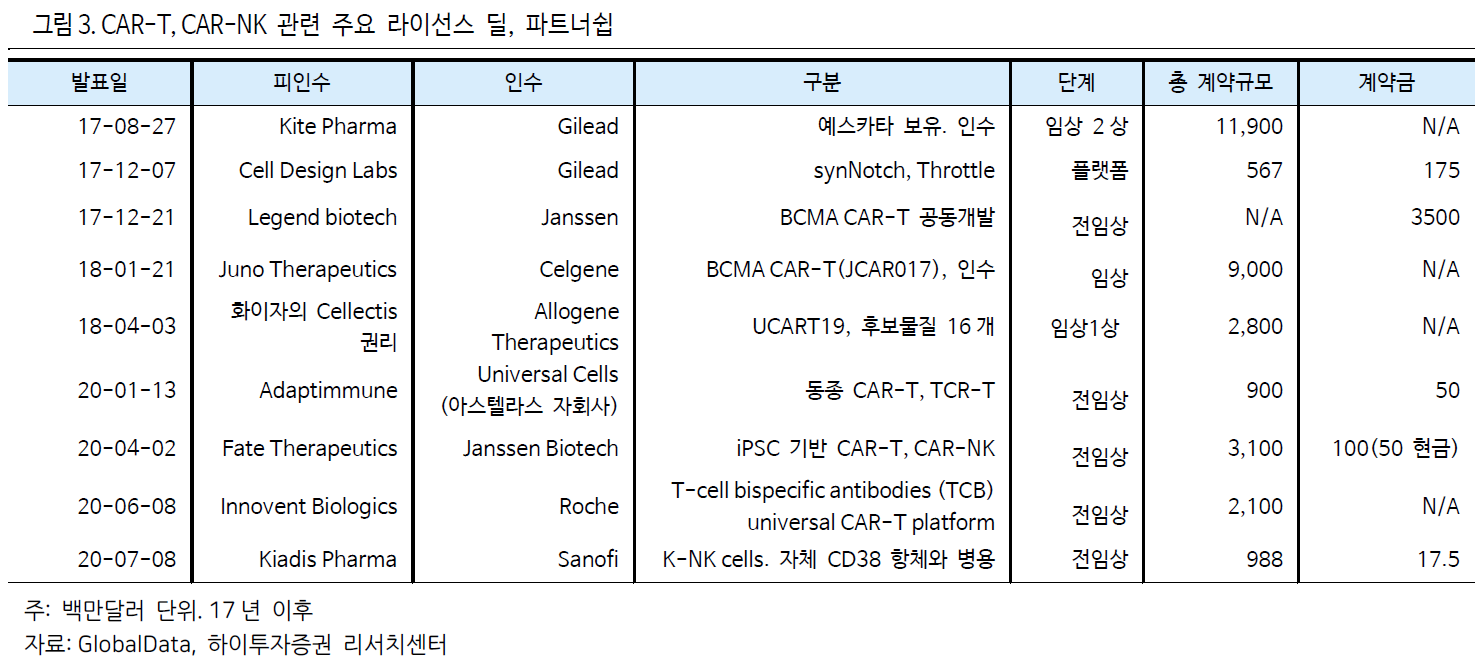
20 년도 들어 다시 계약규모 증가 추세.
<그림 2>를 통해 17 년, 18 년 카이트파마와 주노테라퓨틱스 등의 빅딜로 증가했던 CAR 세포치료제 딜
계약규모는 19 년도에 급감한 후 20 년도 들어 다시 증가하는 모습을 보이고 있음을 확인할 수 있다.
20 년 1 월 아스텔라스는 자회사인 유니버설셀을 통해 동종 CAR-T, TCR-T 개발사인 어댑티뮨과
공동개발계약을 체결하였으며, 4 월 얀센바이오텍은 Fate 의 iPSC 기반 CAR-T, CAR-NK 4 개 후보물질
발굴에 대해 31 억달러의 규모의 공동개발 계약을 체결하는 빅 딜이 있었다.
차세대 CAR-T 를 바탕으로 다시 트렌드로
또한 Allogen Therapeutics 의 ALLO-501 등 차세대 CAR-T 인 동종(Allogenic) CAR-T 의 임상 결과도
발표되고 있으며 BMS 와 얀센의 BCMA 타깃 CAR-T 역시 올해 BLA 신청이 예정되어 있다.
CAR-T 허가 이후, 면역세포치료제 개발이 어디까지 왔는지 다시 돌아볼 시점이다.



기존 CAR-T의 미충족수요
CAR-T는 치료 대안이 없는 말기 백혈병 환자에게 단 한번의 투약으로 종양이 없어지는 결과
(ORR 81%, 완전관해 60%)를 보이며 주목 받기 시작했다.
하지만, 노바티스의 킴리아, 길리어드의 예스카타는 17년도FDA 허가를 받았으나 널리 상용화됨에 있어
어려움이 있었다.
CAR-T의 주요 한계점
CAR-T의 주요 한계점으로는
1) CRS(사이토카인 방출 신드롬), 신경독성 등의 부작용
2) 자가 유래에서 오는 어려움(복잡한 생산과정에 따른 높은 비용, 배양에 시간 소모,
환자의 상태에 따른 품질의 불균질함)
3) 암세포가 CAR가 타겟하는 TAA의 발현을 줄여 발생하는 내성과, 고형암 대상 적용이 어려운 점 등이 꼽힌다.


CAR-T 관련 안전성 이슈들
CAR-T의 대표적 부작용으로는 1) CRS(Cytokine Release Syndrome)와 2) 뇌부종 등으로 나타나는
신경독성, 그리고 3) 암세포 외 다른 장기에 작용하는 off target toxicity가 있다.
예스카타의 임상 2상 ZUMA-1 trial에 따르면, 13%의 환자에게서 grade 3 이상의CRS가 발생하였으며 뇌
부종 등 신경독성은 28%의 환자에게서 발생한 것이 확인된 바 있다.
이는 CAR-T의 작용 기전과 연관이 있다. CAR-T가 CAR의 scFv 를 통해 암세포의 외부 항원을 인식하면,
다양한 cytokine(면역 활성 물질, IL-1, IL-6, IFN-γ, TNF-α 등)을 분비하며 증식 활성화되어
암세포를 공격한다. 이 과정에서 cytokine이 과도하게 분비되어 CRS가 발생한다.
현재 CAR-T로 인한 CRS를 조절하기 위해 IL-6 억제제인 악템라(Toclizumab)가 FDA 허가되어 있다.
CAR-T가 신경 독성을 유발하는 과정에 대해서는 아직 명확하게 밝혀져 있지는 않다.
CAR-T의 활성화 과정에서 분비된 cytokine이 BBB의 내피세포(epithelial cell)을 손상시킬 수
있다고 알려져 있다.

CAR-T 의 복잡한 생산 과정
CAR-T 는 자가유래(autologous) 면역세포 치료제로, 환자 맞춤형으로 제작된다.
환자의 혈액에서 백혈구를 추출한 후 복잡한 제조 공정을 거쳐 다시 환자에게 재 투여 되는 방식이다.
CAR-T의 생산 과정은 간략하게 다음과 같다.
1) 환자의 혈액에서 백혈구성분리채집(leukopheresis) 과정을 거쳐 T 세포를 추출.
2) T-cell 을 선별하고 활성화.
3) 바이러스 벡터를 사용하여 CAR를 도입하고 증식(Expansion). 이를 동결건조한 후 환자에게 재투여
환자의 상태에 따라 백혈구의 상태가 달라 말기 암 환자의 경우 생산에 실패할 수 있고, 생산에 약 3주
(킴리아 약 22일,예스카타 약 19일)의 시간이 소요되어 급성 환자에게 바로 투여가 불가능하다.
또한 추출과 가공 과정에서 병원-공장-병원의 운송 과정이 필요하나 해당 과정이 하루 이내에 신속하게
이루어져야 한다. 이 역시도 CAR-T의 상업화에 가장 큰 걸림돌이다.

왜 CAR-T는 고형암에 어려울까?
현재까지 유의미한 임상 결과를 낸 고형암 CAR-T는 없는 상황이다.
혈액암에서 높은 반응률을 보여준 CAR-T가 고형암의 적용에 어려움을 겪는 이유는
크게 다음과 같이 생각해 볼 수 있다.
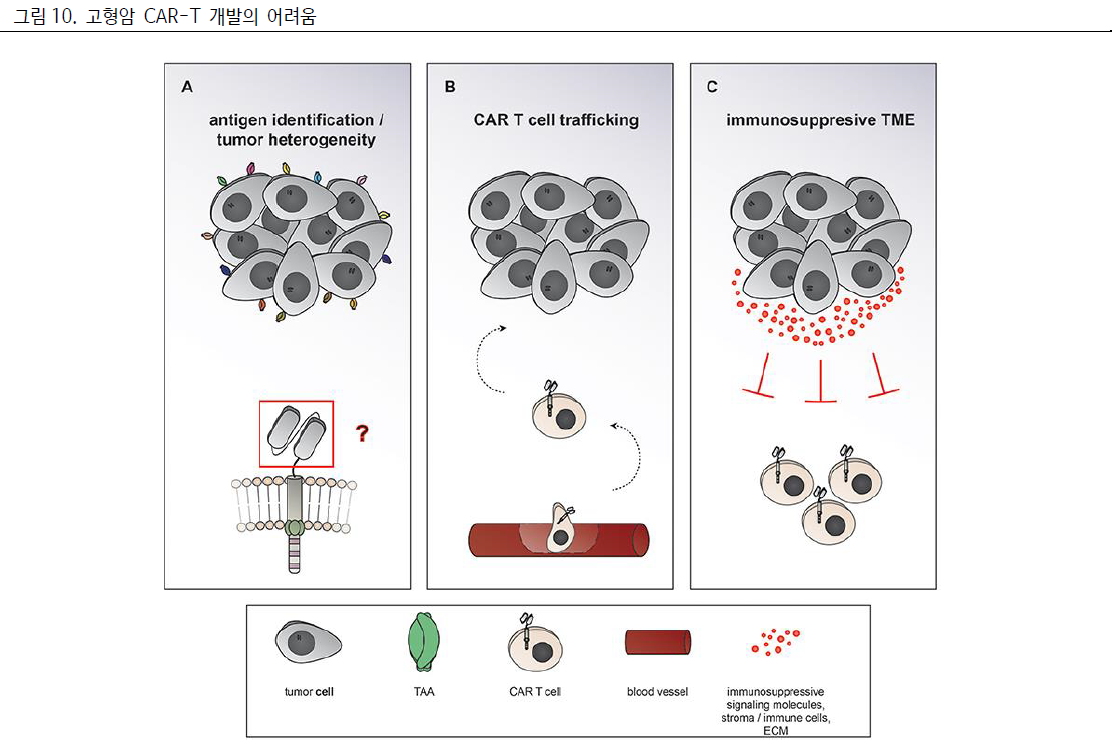
1) 고형암 암조직의 불균일성에 따라 항원 설정이 어렵다.
CAR-T는 CAR의 scFv가 타겟하는 암의 외부 항원을 인식하여 공격한다.
그러나 혈액암과 달리 고형암은 암종 내의 암세포 별로 발현하는 표면 항원이 일정하지 않아, 한가지 항원을
타겟했을 때 낮은 유효성을 보일 수 있다.
또한 TAA가 고형암에만 존재하지 않고 정상 세포에도 존재하여 off target toxicity를 나타낼 수 있다.
이를 극복하기 위해 여러 항원을 타겟하거나, 새로운 TSA(Tumor Specific Antigen)을 찾는 방법이
연구 되고 있다.
2) 면역 세포가 고형암 조직에 도달하는 침윤(infiltrating)이 어렵다.
혈액암은 별도의 침윤 과정 없이 바로 혈중에서 작용할 수 있으나, 고형암에 작용하기 위해서는 항원을
인식한 후, 고형암에 도달해야 한다.
혈중의 CAR-T는 일차적으로 혈관 벽을 투과 후에 고형암의 물리적, 화학적 장벽을 뚫어 암세포에 도달하는
침윤(infiltrating) 과정이 필요하다.
이를 위해서는 T 세포의 종양 부위로의 이동(trafficking)을 높이고, Collagen 등으로 구성된 물리적 장벽
(Extra cellular matrix)을 통과할 수 있는 물질의 분비, 비정상적 혈관의 정상화 등이 필요할 것으로 생각된다.
이를 위해 CAR-T에 암에서 분비하는 chemokine을 인식하는 1) chemokine receptor(CCR, CXCR)의
발현을 높이고, 2) Extracellular matrix를 분해할 수 있는 Heparanase(HPSE)를 분비하게 하며,
3) VEGF 저해제와 병용하는 등을 통해 면역세포의 침윤을 높이는 방법이 연구 중이다.

3) 면역세포가 억제되는 종양미세환경에서 살아남아야 한다.
종양미세환경은 종양 주변의 환경으로 신생 혈관, 세포외기질, 섬유아세포 등으로 이루어져 있다.
종양 미세 환경에서 CAR-T의 작용이 어려운 것은
1) 암세포가 잘 자랄 수 있게 면역 억제 세포들(Treg, MDSC, TAM 등)과
2)면역 억제 물질 물질(TGF-β, adenosine 등)이 분포하며,
3) 암세포에는 PD-L1, CTLA-4, LAG3, TIM3와 같이 T세포의 기능을 억제하는 면역 관문이 활성화되어
있는 등의 이유 때문이다.
결국 이러한 면역 세포를 억제하는 종양미세환경(TME)에서 CAR-T의 생존률을 높이기 위한 방법으로,
면역관문억제제, TGF-β 저해제 등과의 병용 등이 활용될 수 있다.
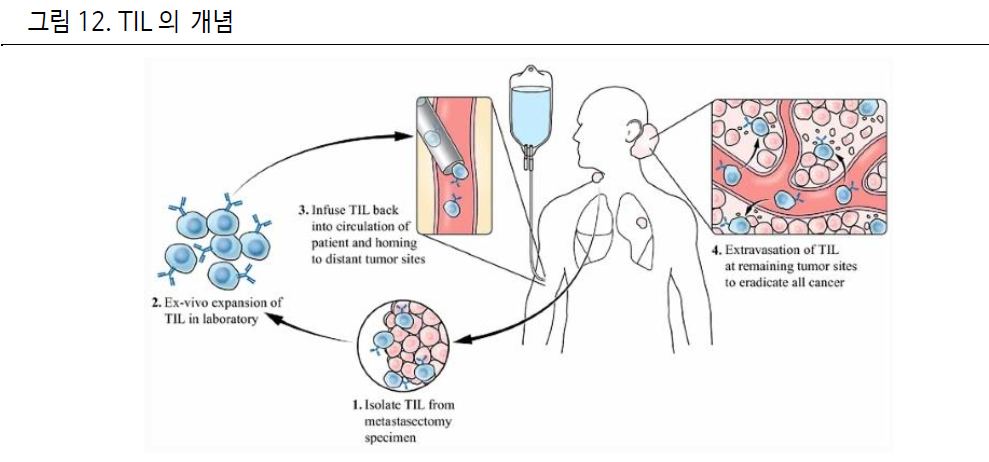
고형암에서 가능성을 보여준 TIL
TIL(Tumor infiltrating lymphocyte)이 면역세포치료제 중 유일하게 고형암종에서 유의미한
결과를 내고 있다.
TIL은 자가 유래 맞춤형 면역세포 치료제로, 환자의 고형암 조직에 있는 “침윤된(infiltrated)” T 세포를
배양하여 재 투여한다.
CAR-T 와 TIL의 차이점은 CAR-T가 scFv이 타겟하는 외부 항원을 인식하는데 반해, TIL은 암 조직의 내부
항원을 포함하는 여러 항원을 인지하는 T 세포들의 조합이라는 점이다.
Iovance는 3차 치료에 실패한 흑색종 및 표준치료법이 없는 자궁경부암 임상 2상에서 각각 35%, 44%의
ORR을 보이며, 세포치료제의 고형암에의 가능성을 보여주었다.
또한, 2020 AACR에서 발표한 전이성 비소세포폐암을 대상으로 하는 1L/2L 임상 1상 결과에서도 25%의
ORR을 보인 바 있다.
다만TIL은 적용이 생검이 가능한 고형암종으로 한정적이라는 한계점이 존재하며, 고형암 CAR-T에 대한
미충족 수요는 여전히 존재한다.

동종(Allogenic) CAR-T, 어디까지 와 있나
동종 유래 CAR-T 개발이 어려운 이유는,
1) 적용된 동종 CAR-T가 수여자의 장기를 공격하는 GVHD(Graft versus host disease, 이식편대숙주병)을
유발할 수 있다는 점과, 2) 적용된 동종 CAR-T가 수여자의 T세포에 의해 제거될 수 있다는 것이다.
1) GvHD를 피하기 위해서는 CAR–T의 TCR(T-cell Receptor)를 제거해야 한다.
이를 위해 TCR을 코딩하는 TRAC 유전자를 제거(Knock out)하는 방법이 주로 사용된다.
이를 위해 TCR을 코딩하는 TRAC 유전자를 제거(Knock out)하는 방법이 주로 사용된다.
Celyad는 특이적으로 TCR을 억제하는 TIM3를 발현시켜 TCR의 기능을 억제하는 방법을 사용하고 있다.
2) 또한, 적용된 CAR-T의 지속시간을 높이기 위해서는 수여자의 T 세포에 의해서 제거되는 것을 막아야 한다.
해당 부분에는 두 가지 접근이 주로 이루어지고 있다.
Allogene Theapeutics와 Cellectis는 동종 CAR-T의 지속시간을 늘리기 위해 CD52 항체인
alemtuzumab(lymphocyte- depleting agent)을 환자에게 투여해 공여자의 면역을 줄여 공여자의
T세포가 CAR-T를 공격하지 않도록 한다.
그러나 CD52 항체는 수여자의 T세포 뿐 아니라 투여된 CAR-T를 저해 할 수 있어, CAR-T의 CD52를 제거하는
과정이 필요하다.
또한 T세포는 MHC1에 제시된 항원을 인식하므로 CAR-T의 MHC1을 제거하는 방법 역시 사용되고 있다.
CRISPR와 Sangamo는 MHC1을 코딩하는 B2M 유전자를 제거(knock out) 하는 전략을 사용하고 있다.
CRISPR는 현재 3개 동종 CAR-T 파이프라인에 대한 임상을 진행 중에 있으며, 신장암을 적응증으로 하는
고형암 타겟 CD70 CAR-T가 올해 6월 임상에 진입한 바 있다.



동종(Allogenic) CAR-T 임상 결과 보기
ASCO 2020 에서는 2건의 동종 CAR-T 결과 발표가 있었다.
Allogene Therapeutics는 ALLO-501의 임상 1상(ALPHA trial)과, Celyad의 CYAD-101의
1상 결과를 발표하였다.
특히 주목 받은 파이프라인은 ALLO-501이다.
ALLO-501은 TCR, CD52를 제거한 동종 CD19를 타겟하는 동종 CAR-T 파이프라인이다.
이번에 발표한 임상1상은 r/r B cell 또는 Follicular cell lymphoma
(재발성/불응성 B세포 또는 여포성 림프종) 환자를 대상으로 ALLO-501을 3개 용량으로 투여하였으며,
2개 용량으로 Lymphodepletion Regimen(CD52 항체 등, 이하 LD)을 CAR-T 투여 전에 진행 하였다.
안전성 측면에서는 GvHD가 발생하지 않은 부분이 고무적이었으며, 유효성 부분에서는 킴리아,
예스카타 대비 약간 낮은 ORR을 보였지만 충분의 유의미한 결과를 보였다.


Ⅱ. Beyond CAR-T. CAR-NK
NK 세포치료제는 T 세포치료제 특히, CAR-T 의 한계점을 극복할 수 있는 대안으로 최근 주목 받고 있다.
NK 세포치료제의 CAR-T 대비 장점으로는, 1)별도의 Gene engineering 없이 동종이 가능하며,
2) CRS 등 부작용이 적어 안전성이 우수하고, 3) 암세포가 표면 항원(TAA)의 발현을 줄여서 발생하는
CAR-T 의 내성 암종에도 적용이 가능할 것으로 기대되는 점 등을 꼽을 수 있다.
이러한 트렌드에 맞추어 최근 NK 세포치료제 관련 딜이 활발하게 이루어지고 있다.
20 년 이전까지 NK 관련한 빅딜은 거의 전무한 수준이였으나, 20 년 2 월 MD Anderson 의
CD19 CAR-NK 1/2a 상 결과 발표 이후 올해 들어 연달아 2 건의 빅 딜이 발표되었다.
얀센 바이오텍은 Fate Therapeutics 와 CAR-T, CARNK 4 개 후보물질에 대한 공동 개발 파트너쉽을 총
계약규모 $3.1B 에 체결하였으며, 사노피는 Kiadis Pharma 의 동종 NK 세포치료제 3 개 파이프라인을
약 $1B 규모에 도입하였다.
또한 동종 NK 세포치료제 개발사인 nKarta 는 20.07.10 일자로 상장하여, 약 $1B 의
시가총액을 형성하고 있다.
NK 세포치료제에 대한 관심이 올라오는 트렌드의 초입에 있는 것으로 판단된다.



NK 세포 치료제 – CAR-T의 대안이 될 수 있을까?
NK세포치료제의 CAR-T 대비 장점으로 1) NK는 별도의 engineering 없이 쉽게 동종이 가능하며,
2) CRS, 신경독성 부작용에서 상대적으로 자유롭고,
3) 암세포가 TAA의 발현을 줄이더라도 인식이 가능하다
(CAR-T의 내성의 원인)는 장점이 있다.
1) NK 세포는 별도의 gene engineering 없이 타가 유래(동종)가 가능하다.
T cell은 TCR-MHC 결합을 통해 항원을 인식한다.
이 과정에서 공여자 T세포의 TCR과 수여자의 MHC가 일치하지 않을 경우, TCR-MHC 결합 과정에서
T cell이 수여자 세포를 비자기로 인식하여 공격하는 GvHD(이식편대숙주반응)이 발생한다.
이러한 T cell의 특성 때문에 동종 CAR-T의 개발을 위해서는 T세포의 TCR을 제거하는 유전자 조작
(gene editing) 과정이 동반되어야 한다.
그러나 NK세포치료제의 경우 TCR을 통한 항원 인식이 필요하지 않으며 이에 따라 gene engineering
없이 동종이 가능하다.

2) CRS, 신경 독성 부작용이 적을 것으로 생각된다.
NK 세포치료제는 CAR-T에 비해 CRS, 신경 독성 등 부작용에서 자유롭다고 생각되고 있다.
올해 2월에 발표한 MD-Anderson의 CD19 CAR-NK의 임상 1/2상 결과에서도,
GvHD, CRS가 발견되지 않았다.
이는 NK 세포와 T 세포의 분비하는 Cytokine의 종류가 다르며, NK 세포의 경우 clonal expansion이
T세포 대비 약하고 memory 능력이 T세포 대비 약하기 때문으로 생각되고 있다.
3) 종양연관항원(TAA)을 숨겨서 생기는 CAR-T 내성 암에도 작용할 수 있다.
CAR-T의 한계점으로 내성 또한 지적된다. 이는 항암 표적항체치료제에 내성이 생기는 기전과 유사하게,
CAR가 타겟하는 암세포 표면의 종양연관항원(TAA, Tumor Associated Antigen)을 암세포가
숨겨서 발생한다.
그러나NK 세포는 선천면역세포로 복합적인 신호를 통해 세포를 구분하여 살상하며, 이에 따라 TAA를
숨긴 암에도 작용할 수 있을 것으로 기대된다.

NK 세포치료제 개발을 위한 기반 기술들
NK 세포치료제 개발에는 다양한 기반 기술이 필요하다.
1) NK 세포의 배양 기술.
2) ADCC(Antibody-dependent cellular cytotoxicity)를 활용하는 항체 병용 투여를 위한
CD16의 효과적인 발현 능력.
3) CAR(Chimeric antigen receptor)를 도입하여, 표적 능력과 강한 활성을 가지게 하는 것.
4) 활성화 수용체의 발현을 올리고, cytokine receptor 발현을 올려 Tumor infiltrating 능력을
올리는 등의 gene editing.
5) iPSC 유래 NK 세포 플랫폼을 구축하는 것.

1) 초기의 NK세포치료는 NK세포의 활성이 저하되고 수가 줄어 있는 암 환자들에게,
NK 세포를 증식시키고 활성을 높여 투여하는 개념이다.
초기 단계에서의 핵심 기술은 NK 세포의 배양, 활성화 능력이다.
NK 세포는 T세포에 비해 배양이 까다로우며, 이 부분을 해결하는 것이 NK 세포치료제 개발의
첫 단계라고 할 수 있다.
2) NK세포는 항체와의 병용을 통해 표적성을 가질 수 있다는 것이 특징이다.
NK세포는 CD16을 표면에 발현하고 있으며 CD16은 항체의 Fc 부분과 결합하여 ADCC
(Antibody- dependent cellular cytotoxicity)를 할 수 있게 된다.
따라서 NK 세포의 배양 뿐 아니라 배양된 NK 세포의 CD16 발현 정도에 따라
항체와의 병용에서 다른 유효성을 보일 수 있다.
3) 항체 병용 투여를 통해, 암 항원의 표적화는 가능하지만, NK에 CAR를 도입한
CAR-NK 역시 의미가 있다.
CAR를 통해 extracellular domain의 ScFv(Single-chain variable fragment)을 통한 암세포 외부 항원
(TAA)을 표적 가능하게 하며, intracellular domain을 통해 세포의 증식과 활성을 높일 수 있다.
4) CAR-T와 마찬가지로 CAR-NK에도 여러 gene editing이 활용될 수 있다.
NK 세포는 activating ligand를 통해 손상된 세포를 인식할 수 있다.
이러한 activating ligand에는 NKG2D 등이 있으며 해당 ligand의 조절을 통해 활성화 능력을 높일 수 있다.
또한 고형암에의 작용을 높이기 위해 1) chemokine receptor(CCR, CXCR)의 발현을 높이고,
2) Extracellular matrix를 분해할 수 있는 Heparanase(HPSE)를 분비하도록 하는 등의 gene editing 역시
CAR-NK의 향후 과제이다.
5) 또한 동종 세포치료제의 경우, 유래에 따라 특성이 달라질 수 있다.
현재 NK 세포치료제의 유래로는 ① 말초 혈액(PB), 제대혈 유래(CB) 등 공여자의 혈액 유래,
② NK92 등의 세포주 유래 ③ 제대혈의 줄기세포 유래,
④ iPSC(Induced pluripotent stem cell, 역분화 줄기세포) 유래가 연구되고 있다.
혈액(말초혈액, 제대혈)에서 유래로 하는 경우, 자연의 상태와 유사한 NK를 만들 수 있으며, 제한된 자원
(혈액)에서 만들어야 하므로 배양 능력이 중요하다. 초기에는 말초 혈액을 주로 사용하였다.
그러나 공여자 별 NK 세포의 이질성, 배양이 진행됨에 따라 발생하는 NK cell exhaustion 문제(배양이
진행되면서 분화능과 활성이 떨어지는 것)등에 의해 말초 혈액보다 상대적으로 “어리며”
품질이 균일한 제대혈(Cord Blood) 유래 역시 사용되고 있다.
MD Anderson과 녹십자랩셀은 제대혈을 사용 하고 있으며, nKarta는 말초 혈액을 사용 중이다.
NK92 세포주는 혈액암에서 기원한 세포주로 NK 세포로 분화하는 특성이 있다.
NK92 세포주는 무한 증식이 가능하므로 공여자의 혈액이 필요하지 않아 경제적이라는 장점이 있다.
그러나, 암세포에서 유래한 세포주임에 따라 발암성에 대한 우려가 있으며 이에 따라 투여 전 방사선
조사가 필요하다. 이러한 부분이 NK 세포의 활성을 저해시킬 수 있다.
NantKwest가 NK92세포주를 사용하고 있다.
iPSC(Induced pluripotent stem cell, 역분화 줄기세포) 유래는 NK92의 경제성과 제대혈의 어린 세포의
장점을 동시에 가지고 있다.
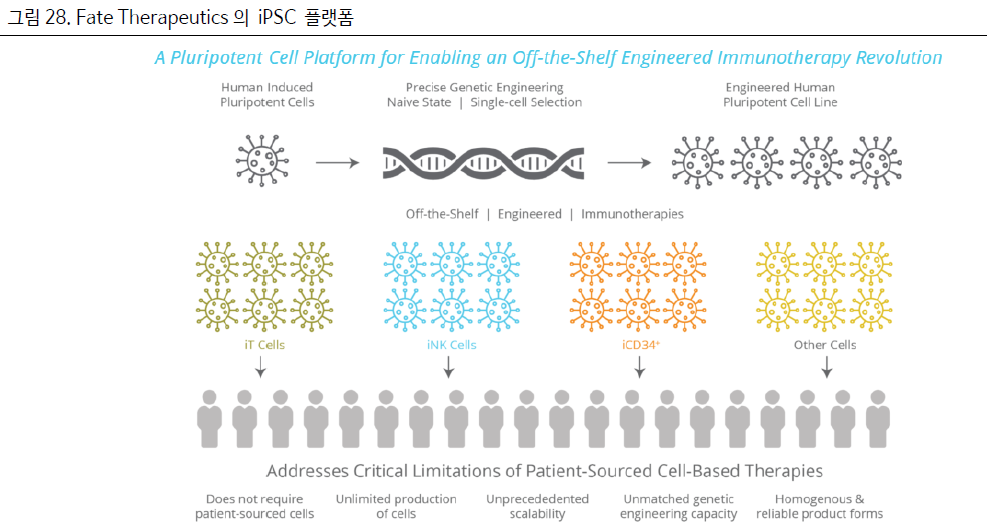
Fate Therapeutics가 iPSC 플랫폼을 기반으로 NK세포, T세포 치료제를 개발 중에 있다.
NK 빅딜 보기 1 – Fate와 Janssen의 딜
얀센바이오텍은 Fate와 $3.1B 규모로 공동개발 계약을 체결하였다.
Fate의 핵심 역량은 “iPSC (Induced pluripotent stem cell, 역분화 줄기세포) 플랫폼을 기반으로 하는
” 면역세포 치료제 개발에 있다.
iPSC란, 줄기세포가 아닌 체세포에 인위적인 자극을 가해 만든 배아줄기세포와 같은 만능분화능
(Pluripotency,우리 몸을 이루는 모든 세포로 분화가능)을 가지게 된 세포를 말한다.
Fate Therapeutics는 iPSC에 gene engineering을 통해 적절한 특성을 가진 NK, T 세포로 분화하는
iPSC cell line을 만들었으며, iT(T세포), iNK(NK세포), iCD34+ 등의 cell line을 보유 하고 있다.
iPSC 플랫폼의 핵심 장점은 1) 무제한으로 분열 가능한 iPSC를 사용함으로써, 공여자의 혈액 없이 동종
세포치료제를 만들 수 있다는 점이다.
이를 통해 균일한(homogeneous)한 제품을 만들 수 있으며 경제적이라는 장점이 있다.
또한 2) iPSC에서 만든 NK세포는 여러 단계의 배양을 거치지 않은 “어린” 세포로 활성과 분화능이 우수하고
gene engineering에도 유리할 수 있다.
Fate Therapeutics는 iPSC 플랫폼을 기반으로 동종 T, NK 치료제를 개발하고 있으며, 얀센 바이오텍은
Fate의 i PSC 플랫폼을 기반으로 한 CAR-T, NK 4개 후보물질에 대해 공동개발을 체결하였다.


NK 빅딜 보기 2 – Kiadis와 Sanofi의 딜
20.07.08일자로 사노피는 Kiadis의 K-NK004 파이프라인과 2개의 추가 후보물질을 총 계약규모 €875M
(약 1조 1400억원)에 도입하였다.
사노피는 K-NK004를 다발성 골수종을 적응증으로 개발 중인 CD38 항체인 Sarclisa와의 병용 요법으로
개발할 계획이다.
현재 CD38 항체로 얀센의 다잘렉스가 허가 받았으며, 19년 기준 약 30억달러의 매출을 기록하였다.
사노피의 Sarclisa는 NK004와의 병용을 통해, 후발주자로서의 유효성을 높이고 후발주자로서의 약점을
극복하기 위해 이번 딜을 진행하였다고 해석된다.
이번 딜은 CAR-NK가 아닌 NK 세포의 ADCC(Antibody-dependent cellular cytotoxicity)를 활용하는
부분에서 나온 딜이라는 점이 특이적이다.
K-NK004은 CD38을 KO(Knock Out. 유전자 제거) 하였다.
이는 CD38 항체와 병용 투여 할 때, 투여된 K-NK를 CD28 Ab가 억제하지 않게 하기 위해 디자인 된 것으로
병용 투여를 위한 gene engineering이라고 볼 수 있다.
앞으로 NK 세포치료제와 더욱 다양한 항체들과의 병용이 진행될 것이라 생각된다.

공격적으로 병용 임상을 확대 중인 NantKwest
NantKwest는 크게 3가지 플랫폼을 가지고 있다.
1) haNK는 antibody의 Fc 부분에 붙는 CD16의 발현을 높여, ADCC
(Antibody-dependent cellular cytotoxicity)를 잘 일어나게 한 NK 세포이다.
2) taNK는 CAR-NK로 특정 TAA를 타깃하는 CAR를 도입한 NK 세포이다.
3) t-haNK는 NK의 직접 살상 작용, CD16을 통한 ADCC, CAR를 통한 TAA 인식 3가지를 동시해 할 수 있는
NK 세포로, CD16 발현을 높인 NK에 CAR를 도입한 형태의 NK 세포이다.
동사는 3가지 플랫폼을 바탕으로 화이자/독일머크의 PD-L1 저해제 바벤시오 (Avelumab),
N-803(IL-15 superagonist)를 포함한 다양한 약물과의 병용 임상을 진행 중에 있다.
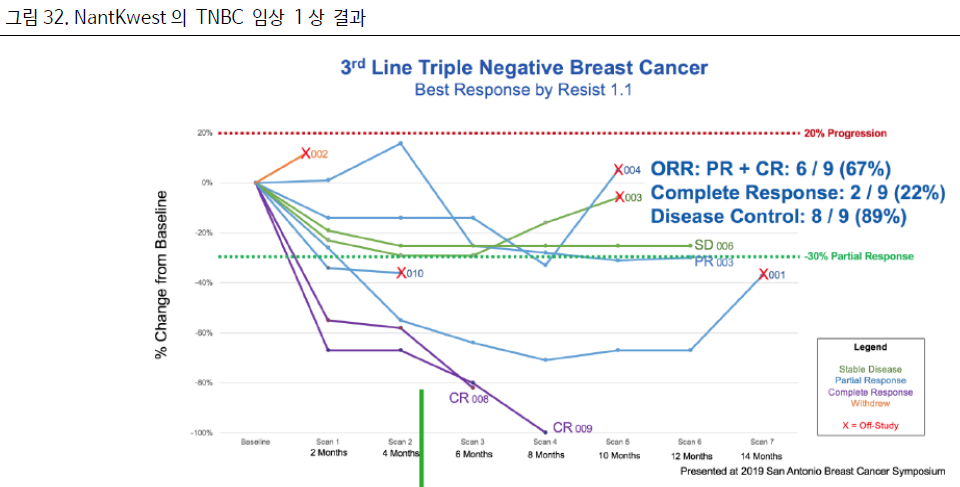
현재 메르켈세포암, 췌장암 1L, 2L 임상 2상과 췌장암 3L, NSCLC 3L 임상 1상을 진행 중에 있다.
19년도 SABCS에서 TNBC 2L 이상을 대상으로 한 임상 1상 결과를 발표한 바 있다.


국내 업체 현황
국내 주요 NK 세포치료제 개발 업체로는 녹십자랩셀, 엔케이맥스, 박셀바이오가 있다.
녹십자랩셀은 동종 NK세포치료제를 개발 중에 있으며, 엔케이맥스와 박셀바이오는 동종 NK 세포치료제의
임상을 진행 중이다.


Ⅲ. Appendix – 면역세포치료제
T세포 vs NK 세포
T세포는 적응면역세포이며 NK세포는 선천면역세포이다.
선천 면역은 인체 내에 항상 존재하는 면역 반응으로, 항원의 제시 과정이 필요 없으며 비 특이적으로
일어나 반응이 즉각적으로 이루어진다.
적응 면역은 항원에 특이적으로 반응하며, 반응에 시간이 걸리는 대신 기억이 가능하다는 특징이 있다.
T세포와 NK 세포의 가장 큰 차이는 항원을 인식하는 과정에 있다.
T cell은 MHC 단백질에 의해 표면에 제시된 항원 조각만 인식하여 활성화된다.
T cell이 항원을 인식하기 위해서는 항원 제시 과정이 우선적으로 필요하다.
이 과정에서는 APC(Antigen Presenting Cells, 수지상세포, 대식세포, B세포 해당)는 Pathogen 등을
잡아먹은 후 MHC2를 통해 Th cell에 항원을 제시한다.
이러한 1) MHC-TCR signal과 2) B7 family-CD28, 3) TNFR family-4-1BB등의 공동 자극 신호들이
Th cell을 활성화시킨다. 활성화된 Th cell은 다른 면역 세포들을 활성화하는 역할을 한다.
MHC1은 자기-비자기를 구분하는 역할을 하며, 바이러스에 감염되거나 암세포가 되어 손상된 세포가
자신의 분자가 아닌 다른 분자를 제시할 경우 Tc(세포독성 T 세포)에 의해 인식되어 살상된다.
MHC란?
MHC는 주조직 적합 복합체로 MHC1과 2로 구분된다.
MHC1은 세포질 내부의 항원을 제시하며, 거의 모든 세포에 존재한다.
MHC1에 의해 제시된 항원은 자기와 비자기를 구분하는 역할을 한다.
바이러스 등에 의해 감염된 세포나 암세포 등 손상된 세포가 자신의 분자가 아닌 다른 분자를 제시할
경우 Tc (세포독성 T세포)에 의해 인식되어 죽게 된다.
MHC2는 외부의 항원을 제시하는 역할을 하며, 이에 따라 항원을 제시하는 세포인 APC
(Antigen Presenting Cell, 수지상세포, 대식세포, B세포)에 존재한다.
APC가 외부 항원을 MHC2를 통해 제시하면, Th cell(도움 T세포)에 의해 인식되며 Th cell은
면역 반응을 활성화한다.

이에 반해 NK 세포의 인식 과정은 크게 4가지로 이루어진다.
1) NK 세포는 MHC1에 의해 정상적으로 자신의 항원을 발현할 경우 세포를 죽이지 않는다.
2) MHC1을 발현하지 않는 세포(일부 암세포 등)의 경우 세포를 죽인다. 다만 강도가 약하며 추가적인
활성화 신호가 필요하다.
3) 체내 세포는 병원체(바이러스 등)에 감염되거나, 스트레스 환경에 의해 activating ligand를 발현하게 된다.
이 ligand가 NK세포의 수용체와 결합하여 활성화되어 세포를 죽인다.
4) MHC1을 통한 자기 항원 발현과 activating ligand의 발현이 동시에 이루어질 경우, 신호 강도의 균형을 통해
판단한다.

CAR(Chimeric Antigen Receptor)란?
CAR은 Chimeric antigen receptor의 약자로, single chain으로 항체의 가변부위를 T세포에 도입해
T세포가 MHC에 제시되지 않은 암세포의 외부 항원을 인식할 수 있게 하기 위해 고안되었다.
CAR은 3가지 영역으로 이루어진다.
1) 외부의 scFv 영역 : 항체의 가변 부위(VH, VL)을 링커로 연결하여 single chain으로 만든 것.
MHC에 제시되지 않은 외부 항원을 인식할 수 있게 한다. 면역 세포가 암에 선택적으로 작용하도록 한다.
2) Transmembrane Domain : 외부와 내부를 연결하는 부위
3) Intracellular Domain : 외부에서 인식된 신호에 따라 T-cell을 활성화하고 증식하도록 한다.
Intracellular domain에 따라 CAR의 세대가 구분된다.
1세대 CAR는 costimulatory domain 없이 TCR의 CD3ξ로만 구성되어 충분한 항암 효과를 내지 못했다.
이후 CD27, CD28, 4-1BB, OX40 등의 costimulatory domain을 도입한 2~3세대 CAR가 개발되었다.

'주식시장 투자전략' 카테고리의 다른 글
| 디지털 뉴딜 주인공은 나야 나 (0) | 2020.09.14 |
|---|---|
| 제약,바이오 - 단역에서 조연으로,주연까지 머지 않았다 (0) | 2020.08.26 |
| 성장주: ‘기대’ 와 ‘불편함’에 대하여 (0) | 2020.07.22 |
| 5G (0) | 2020.07.19 |
| "너무 올랐다" vs "더 간다"…비대면株 '정점' 공방 (0) | 2020.07.16 |